Российское пациентское сообщество открыло сбор средств на доклиническое исследование способа победить редкую наследственную болезнь — дистрофию сетчатки. Заболевание может приводить к полной потере зрения, у него сотни разновидностей, но лечение найдено лишь для одной. Теперь пациенты хотят изменить эту ситуацию и оплатить исследование редактирования поломки гена, отвечающего за слепоту. Для России эта инициатива — первая в истории, хотя в мире спонсирование научных разработок больными и их родственниками — стандартная практика. Как это может изменить российскую медицину — в материале «Ленты.ру».
«Население небольшого города»
— Когда сыну было десять лет, заметил, что он держит книгу у носа, — рассказывает Кирилл Байбарин, руководитель пациентской организации «Чтобы видеть!» — Ну, думаю, близорукость, ничего страшного. Приходим к офтальмологу, а подобрать очки не получается. И там я впервые услышал страшные слова: наследственная дистрофия сетчатки, синдром Штаргардта. Вышел, залез в «Википедию», а там финал — слепота.
Первые дни вся семья была в шоке. Потом в научно-исследовательском институте глазных болезней имени Гельмгольца им сказали, что скорее всего это будет не полная слепота, а слабовидение. То есть когда от нормального зрения остается 5-10 процентов.
— Конечно, было очень страшно, — продолжает Байбарин. — Стал искать информацию, нашел много англоязычных аккаунтов на Facebook, тематических групп. И увидел там то, что перевернуло мой взгляд — в этих группах очень много счастливых людей. Есть немало технических устройств, специальных технологий, которые помогают адаптироваться к обычной жизни. В России о всех этих способах недостаточно известно. С сыном многое пробовали. Начал рассказывать врачам о том, как и что улучшает жизнь слабовидящих. Врачи стали направлять ко мне пациентов, которым только-только поставили диагноз. Я подсказывал, как справляться со всем. Так постепенно образовалось «Чтобы видеть!»
Байбарин вдохновлялся опытом международной общественной организации пациентов с наследственной дистрофией сетчатки Foundation Fighting Blindness. Ее миссия — просветительская, а самая главная цель — стимулировать появление новых технологий лечения. Однако к последней задаче российские пациенты подступать не решались — это казалось чем-то неподъемным.

Фото: Annie Spratt / Unsplash
Сейчас Максиму Байбарину — 16 лет. Он видит не так, как большинство людей. При синдроме Штаргардта поражается центральное зрение, при этом периферическое — сохранено. Перед глазами у больного — мутное пятно. Чтобы читать, смотреть, распознавать лица, необходимо сильное увеличение. Но в то же время больные довольно свободно могут перемещаться в пространстве, так как видят, что у них под ногами.
Синдром Штаргардта — это один из множества недугов наследственной дистрофии сетчатки. Сегодня известно более чем о 1,5 тысяче различных типов дистрофий. Они различаются по названию мутировавшего гена и тому, где именно он сломан. От этого же зависит, в каком возрасте болезнь может стартовать. Разброс огромный — от трех месяцев до 30-40 лет. Несмотря на то что клинические проявления у болезней сетчатки разные, исход один — слепота.
Еще совсем недавно казалось, что наследственные патологии зрения неизлечимы. Но сейчас у пациентов появилась надежда: три года назад зарегистрирован препарат для одного из видов дистрофии сетчатки — амавроза Лебера, вызванного поломкой гена RPE65. И теперь ученые ищут способ «починки» еще нескольких генов, ответственных за другие синдромы.
— Проблема в том, что дистрофия сетчатки — это не только десятки разных заболеваний, — объясняет Кирилл Байбарин. — В каждой из этих болезней есть еще разные подвиды. И везде нужен свой подход. Разработка требует и финансовых, и временных затрат. Заинтересовать фармацевтические компании в рамках доклинических исследований тестировать полторы тысячи подходов, когда нет гарантий, что ключик подойдет, — невозможно.
Но если мы подберем ключик сами, это будет уже громадный прогресс. Появится большой шанс, что бизнес заинтересуется и подхватит эстафету
Сейчас пациентское сообщество «Чтобы видеть!» запустило краудфандинговую кампанию по сбору средств на доклиническое исследование возможности генетического редактирования гена USH2A — основной причины развития синдрома Ашера (Ушера). При этой патологии развивается «тоннельное» зрение: пациент смотрит на мир как будто сквозь трубу. Постепенно ее просвет сужается, пока не превращается в точку. Все это сопровождается прогрессирующей потерей слуха.
— Сказать, какая именно мутация гена в России сегодня самая распространенная, невозможно, — говорит Байбарин. — Нет статистики. Поскольку лечения все равно не существовало, то пациентам просто не рекомендовали сдавать генетические анализы. Потому что это потеря времени, денег, и ничего не дает. По грубой оценке, всего пациентов с наследственной дистрофией сетчатки разных типов у нас в стране 30-40 тысяч человек. То есть население небольшого города.
Ген для пилотного пациентского проекта выбирали эксперты из научного сообщества. Исходили из двух критериев — ген должен быть «сиротой», то есть не охвачен клиническими исследованиями в мире. И второй фактор — должна быть перспектива, то есть биологические предпосылки, дающие надежду на удачу.
— Наша задача — не воспроизвести в России то, что сделано в США или в Европе, а запустить процесс, который нигде в мире не запущен. Или не дошел до каких-то значимых результатов, — объясняет Кирилл Байбарин. — Масштаб работ по дистрофии сетчатки огромный. Нет ни одной фармацевтической компании, ни одного исследовательского института в какой-либо стране, которые бы могли охватить все виды данного заболевания. Именно поэтому существует практика, когда сами пациенты стараются поддержать научные исследования. Чем активнее мы будем стимулировать это, тем больше шансов, что большее количество пациентов получит своевременное лечение.
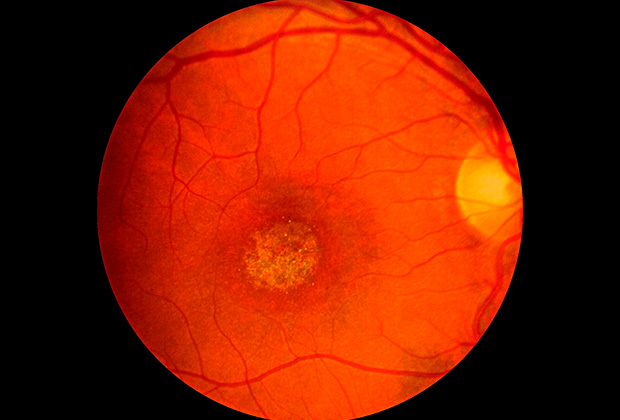
Фото: Chris Barry /Science Photo Library / East News
Всего требуется собрать 18 миллионов рублей. Срок реализации проекта — три года. Исследование будет проводиться на базе лабораторного комплекса научно-технического университета «Сириус» в Сочи. Там есть современное оборудование и команда специалистов, ведущих разработки в области генной терапии. Основные затраты пойдут на закупку реактивов и лабораторных животных с «нужными» мутациями.
Поддержать доклинические исследования — общее решение нашего пациентского сообщества, — заключает Байбарин. — Хотя мы все прекрасно понимаем, что на данном этапе это спасет далеко не каждого из нас. Например, у моего ребенка совсем другой синдром. Но проект поможет проложить путь, который в дальнейшем можно будет пройти проще
Альянс пациентов
Если в России главная миссия пациентских организаций — поиск денег на лекарства и медоборудование, то за рубежом — именно образовательные проекты и стимулирование научных изысканий. Причем пациенты нередко становятся «мотором» лекарственного прогресса. В Италии еще в конце 1990-х годов родители детей с тяжелым комбинированным иммунодефицитом (ТКИД) начали собирать средства на доклинические исследования генной терапии. ТКИД — целая группа болезней, которые развиваются из-за генетического сбоя, поломки одного или нескольких генов. В результате организм теряет способность защищаться от любых патогенов — бактерий, вирусов, грибков. Банальная простуда для такого человека может стать смертельной. Это стало толчком к появлению технологии исправления гена, отвечающего за одну из форм ТКИД.

Фото: страница «Чтобы видеть» на Facebook
В Америке домохозяйка без медицинского образования Шэрон Тэрри взяла мир науки штурмом, когда у ее сына и дочери обнаружили редкое генетическое заболевание — эластическую псевдоксантому (PXE). Когда был поставлен диагноз, о болезни мало что было известно, кроме того, что все системы организма преждевременно стареют, больные редко доживают до 30 лет. Благодаря энтузиазму Тэрри удалось расшифровать ген, отвечающий за недуг. Причем пациенты выступили за то, чтобы информация о научных исследованиях была общедоступной. Появилась организация «Генетический альянс» — международная сеть, куда входят пациентские, научные и медицинские организации. Были созданы банки биоматериалов, реестры редких больных. Доступ к ним свободен для всех исследователей.
Концентрация умов
Ольга Германенко, директор благотворительного фонда «Семьи СМА»:
— Мы привыкли жаловаться, что в России не развивается наука. Предполагается, что она должна возникнуть каким-то магическим образом из ничего и сразу же приносить результаты. Но так, к сожалению, не бывает.
Прежде чем какой-то продукт — будь то лекарство, какие-то медицинские девайсы или вообще что-то полезное — появляется у пациента, этому предшествует огромное количество этапов. Часто они незаметны обычному человеку, пациенту, никак не связанному с научным миром. Все начинается с гипотез, которые требуют проверки. Сначала — теоретической, затем — практической и лабораторной. И только после того как догадки признаются перспективными, начинаются предклинические и клинические исследования.
И речь идет не обязательно о разработках чего-то конкретного. Это может быть, например, поиск механизмов заболевания, какие факторы влияют на его развитие. Как правило, этим занимаются узкие группы профессионалов. И как правило — на средства грантов. Редко когда фармацевтическая коммерческая компания будет поддерживать исследование в какой-то неизведанной, непонятной отрасли.
Фото: Валерий Шарифулин / ТАСС
Потому что такие «предварительные» изыскания достаточно дорогостоящие. Нужны средства и на работу специалистов, и на оснащение лаборатории. Например, исследование по СМА (спинально-мышечная атрофия) проводится на специальных живых моделях, мышах, мухах, червях. Поскольку в природе практически невозможно встретить организмы, которые бы повторяли модель заболевания, приходится создавать ее вручную. То есть животные — генетически модифицированы. Как говорил мне один исследователь, на создание одной такой мыши со СМА, например, уходит порядка 10 тысяч евро. Я не могу сказать, насколько это достоверно, поскольку с этой отраслью соприкасаюсь лишь по касательной. Но, тем не менее, суммы огромные. И ведь одним животным не обойдешься в исследованиях.
Бывают частные фонды, которые поддерживают именно науку, есть государственные гранты. Если смотреть на зарубежный опыт, то в области СМА изначально очень многие исследования, в том числе и те, благодаря которым появились патогенетические лекарства, на самом раннем этапе поддерживались именно пациентскими организациями.
Наш российский фонд «Семьи СМА» активно участвует в «СМА Европы». Изначально эта организация была создана в 2005-м году, когда нашли ген, отвечающий за возникновение СМА. Но тогда было непонятно, что это означает и что дальше. Организация создавалась с целью поддержки именно вот таких вот исследований. Пациенты из разных стран объединились, чтобы сформировать бюджет для поддержки интересных разработок. У нас до сих пор есть что-то наподобие конкурса на получение грантов для каких-то базовых исследований. Любой ученый из любой страны мира может подать свою заявку. Потом они отбираются экспертами из научного комитета. То есть не самими пациентами, а компетентными специалистами.
Когда я читаю эти заявки, то ничего не понимаю. Там какие-то цифры, какие-то просчеты, очень специфические данные. В дальнейшем это может превратиться в какую-то выверенную траекторию. Мы ведь, например, до сих пор не знаем, почему пациенты с одним и тем же типом заболевания имеют разную скорость прогрессирования болезни, разные течения. Какие факторы на это влияют? И будет ли создано лекарство, которое позволит восстанавливать погибшие мотонейроны?
Я пару лет назад у себя в Facebook попыталась провести опрос на тему — готовы ли наши пациенты «скинуться» на науку, поддержать какие-то исследования и разработки. Тогда все комментарии были наподобие «ой, нет, да зачем, какая-то фигня». То есть встречено с очень большим непониманием. И я сформулировала вопрос с предположением — а что, если бы это были российские исследования? Многие отвечали, что «если бы были зарубежные ученые — мы бы подумали еще, а нашим — не доверяем».
А не так давно я снова решила повторить этот вопрос — поддержали бы сейчас? И честно говоря, была удивлена: ответы поступили совсем другие. Почему так произошло — не знаю. Возможно, у пациентов появилась вера, что можно что-то изменить. Хотя выборка у меня, конечно, небольшая. Но все же это вдохновляет, это — хороший знак. Может, действительно есть шанс, что в России будет развиваться базовая наука. Мы будем делать свои, уникальные находки, а не только копировать то, что уже кто-то когда-то придумал.

