Антибиотики все чаще теряют свою эффективность. Как в России нашли решение этой проблемы?

Фото: Carla Carniel / Reuters
Российские ученые предложили новый метод борьбы с устойчивыми к антибиотикам бактериями на основе пептидов. Они открыли так называемый механизм направленной коагрегации, который основан на взаимодействии пептида, способного образовывать фибриллы, с бактериальным белком, блокируя его активность и подавляя рост микробов. «Лента.ру» подробно рассказывает об исследовании молекулярных биологов из Института теоретической и экспериментальной биофизики РАН и других научных организаций.
Средство против кризиса
Одной из серьезных глобальных проблем современности является кризис антибиотиков. Все больше бактерий приобретают устойчивость (резистентность) к лекарственным препаратам, которые были и остаются единственной надеждой на выздоровление для многих пациентов с микробными инфекциями. При этом скорость появления на рынке новых эффективных антибиотиков отстает от темпов распространения резистентности из-за сложности разработки таких препаратов и их внедрения в производство. На стадии клинических испытаний сейчас находятся всего несколько десятков противомикробных препаратов, но и они являются разновидностями уже известных классов антибиотиков. Бактерии потенциально могут очень быстро развить к ним устойчивость, что сделает эти лекарства бесполезными. По оценкам ученых, к 2050 году из-за антибиотикорезистентных инфекций, вызванных супербактериями, будет умирать несколько миллионов человек в год.
Сейчас ученые по всему миру работают над созданием принципиально новых антибактериальных препаратов. Например, такие лекарства обладают иммуномодулирующими свойствами, то есть усиливают иммунитет в борьбе против инфекции, другие — основаны на бактериофагах, то есть вирусах, поражающих бактериальные клетки. Одним из перспективных направлений является получение антимикробных пептидов (АМП), которые состоят из нескольких десятков аминокислотных остатков. В общем случае пептиды действуют, усиливая проницаемость мембран у бактерий через возникновение пор, но существуют и альтернативные механизмы.
Противомикробные пептиды, называемые цекропинами, были впервые обнаружены в гемолимфе насекомых — гусениц шелкопряда Hyalophora cecropia. Позднее пептиды обнаружили у земноводных, млекопитающих и даже растений. Известно, что бактериям гораздо труднее выработать устойчивость против пептидов, однако существует ряд препятствий для их широкого применения в медицине, например, активность in vivo (в живом существе) оказывается ниже, чем in vitro (в лабораторных условиях).

В гусеницах Hyalophora cecropia обнаружили первые известные пептиды
Фото: Michael Hodge / Flickr
Амилоиды против микробов
Ранее учеными было показано, что амилоидогенные пептиды способны подавлять рост микробов, образуя агрегаты (амилоидные фибриллы) с бактериальными белками. Однако оставалось неясным, как способность формировать фибриллы связана со способностью оказывать противомикробный эффект. Чтобы прояснить механизм действия, ученые создали синтезированные пептиды и испытали их действие на ряде бактерий, включая синегнойную палочку Pseudomonas aeruginosa. В качестве целевого белка, с которым должен связываться пептид, был выбран рибосомный белок S1. Это уникальный белок для бактерий, который выполняет множество жизненно важных функций, в том числе регулирует копирование ДНК внутри микроорганизмов. Его отключение (нокаут) приводит к неминуемой гибели бактериальных клеток.
Препараты на основе амилоидогенных пептидов способны подавлять рост микробов, образуя амилоидные фибриллы с важными бактериальными белками
В прошлой работе исследователи уже описали строение белка S1 и обнаружили интересные характеристики, которые не встречаются у других подобных белков. Например, в S1 содержатся несколько одинаковых доменов, называемых ОВ-складкой. Домены — это особые участки белков, которые выполняют специфические функции. Ученые обнаружили, что количество доменов в S1 зависит от типа бактерий. Все грамотрицательные бактерии имеют в белке S1 шесть ОВ-складок, при этом функции каждой из них полностью не определены.
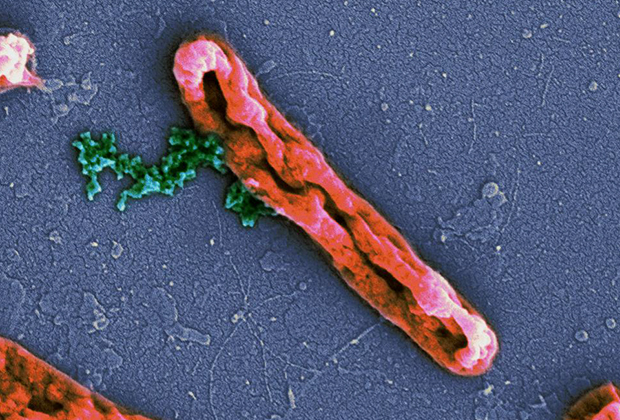
Pseudomonas aeruginosa, СЭМ компьютерная окраска
Фото: Janice Haney Carr / CDC
В новой работе исследователи с помощью методов биоинформатики проанализировали домены рибосомного белка S1 из разных видов грамотрицательных бактерий: E. coli (шесть доменов, 557 аминокислотных остатков), Thermus thermophilus (пять доменов, 536 аминокислотных остатков) и P. aeruginosa (шесть доменов, 559 аминокислотных остатков). Целью работы было выявить аминокислотные последовательности белка S1, которые склонны к агрегации и сами по себе могут обладать антибактериальными свойствами. Иными словами, эти участки при встрече с аналогичными аминокислотными фрагментами образуют фибриллы, блокирующие активность белка S1. Важно то, что эти последовательности не встречаются в эукариотических клетках, поэтому возможность того, что пептиды начнут образовывать агрегаты с человеческими белками, исключается.
Задел на будущее
По результатам анализа ученые синтезировали семь амилоидогенных пептидов из E. coli, четыре пептида из T. thermophilus и четыре пептида из P. aeruginosa. Для того чтобы синтезированные пептиды могли проникнуть через бактериальную мембрану и связаться с S1 белком, ученые сконструировали модифицированные пептиды с добавлением специальных аминокислотных последовательностей, увеличивающих проницаемость клеток.
Сами по себе белки S1 в различных бактериях не образовывали амилоидных фибрилл, однако отдельные участки действительно формировали агрегаты с пептидами. При этом коагрегация приводила к образованию агрегатов разного размера и фибрилл разного диаметра.
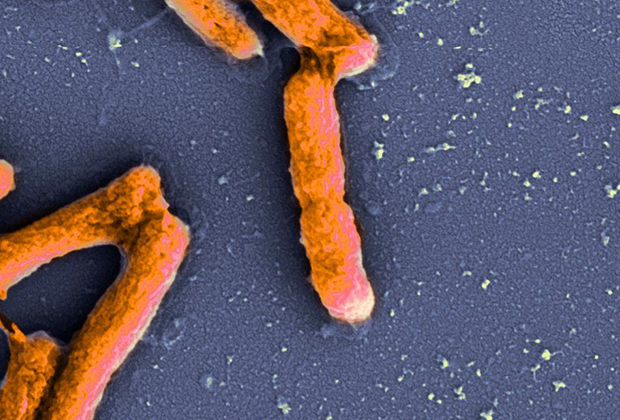
Действие антимикробного пептида против кишечной палочки
Фото: JBC
В случае патогенной бактерии P. aeruginosa сильные антибактериальные свойства среди пептидов, синтезированных на основе предсказанных амилоидогенных областей S1, были обнаружены у пептида R23L, для которого минимальная ингибирующая концентрация (МИК) составляла 8 микрограммов на миллилитр, что сопоставимо с действием антибиотика гентамицина. Среди пептидов из S1 T. thermophilus наиболее эффективным был пептид R23I (МИК около 50 микрограммов на миллилитр), действие которого было сопоставимо с антибиотиком канамицином. Что касается кишечной палочки, то пептиды на основе ее белка S1 не показали такого успеха, как в случае других бактерий. Ученые объясняют это тем, что E. coli обладает некоторой устойчивостью к исследуемым пептидам.
Таким образом, заключают исследователи, рибосомные белки S1 E. coli, T. thermophilus и P. aeruginosa содержат амилоидогенные последовательности, которые могут приводить к агрегации пептидных молекул друг с другом или с другими белками, имеющими сайты агрегации. S1-родственные домены обнаружены и в других бактериальных белках, что может увеличить количество мишеней для потенциальных пептидных препаратов.
Как пишут авторы работы, несмотря на низкую способность бактерий проявлять устойчивость к антимикробным пептидам, для предотвращения и противодействия появлению новых устойчивых к антибиотикам мутантов важно оценить адаптивную способность патогенных бактерий к пептидам. В целом механизм направленной коагрегации, который основан на взаимодействии пептида, способного образовывать фибриллы, с целевым белком, может стать основой для нового класса антимикробных препаратов, способных решить проблему устойчивости к антибиотикам.