Международный научный журнал Journal for ImmunoTherapy of Cancer признал статью российских и бельгийских ученых о новом возможном способе лечения рака лучшей публикацией 2020 года. В этой работе исследователи Института биологии и биомедицины ННГУ создали новую методику, позволяющую бороться с глиомой и фибросаркомой с помощью программируемой клеточной гибели — ферроптоза. «Лента.ру» ознакомилась с текстом статьи и подробно рассказывает о новой «прививке» от рака.
Клеточная смерть
В настоящее время иммунотерапия превратилась в независимую и эффективную противоопухолевую стратегию наряду с хирургией, лучевой терапией и химиотерапией. Иммуногенная клеточная смерть (ICD), то есть гибель клеток в результате воздействия иммунной системы, недавно была признана учеными критическим фактором, определяющим эффективность лечения рака. Концепция ICD включает в себя способность эффективно убивать раковые клетки с помощью активации иммунного ответа, нацеленного на борьбу с опухолями и приводящего к сильному и долгосрочному противораковому иммунитету.
Молекулярные агенты, индуцирующие иммуногенную клеточную смерть, активируют опасный для жизни клетки метаболический путь. Происходит выброс соединений, известных как «молекулярные паттерны, связанные с повреждением», или DAMP. DAMP — это молекулы, которые производятся самим организмом и активируют иммунную систему, когда воздействуют на внешнюю клеточную мембрану. К ним относят, например, АТФ, белок амфотерин или HMGB, кальретикулин (CRT) и провоспалительные цитокины, такие как интерфероны типа I (IFN). При мобилизации DAMP действуют как сигналы опасности и как адъювантные (поддерживающие) молекулы для активации иммунной системы.
Фото: Dr. Gopal Murti / Science Photo Library
Первоначально концепция иммуногенной клеточной смерти была описана для раковых клеток, подвергающихся апоптозу — одному из типов программируемого процесса гибели клеток. Однако рак способен уклоняться от апоптоза и развивать устойчивость к нему. Поэтому ученые проводят исследования других альтернативных механизмов управляемой гибели клеток, подходящих для разработки новых способов борьбы с раком. Таким путем, например, является некроптоз — программируемая некротическая гибель клетки, которая сопровождается взаимодействием с рецептором таких молекул, как протеинкиназа-1 (RIPK1), RIPK3 и псевдокиназы. Индукция некроптоза приобрела первостепенное значение в экспериментальной терапии рака в качестве метода, альтернативного стратегии на основе апоптоза.
Железо против рака
Хотя индукция иммуногенного некроптоза в раковых клетках, по-видимому, является многообещающей с точки зрения активации противоопухолевого иммунитета на экспериментальных моделях мышей, многие виды рака часто развивают устойчивость и к некроптозу. Следовательно, запуск иммуногенного апоптоза или некроптоза не всегда будет оптимальной стратегией лечения раковых опухолей. Очень важно найти новые способы уничтожения опухолевых клеток, инициируя способы гибели клеток, несвязанные с апоптозом и некроптозом.
Ферроптоз — это тип гибели клеток, происходящий из-за железозависимого окисления липидов. Он может избирательно запускаться в клетках, экспрессирующих мутантные гены семейства RAS. Эти гены, а также кодируемые ими белки, участвуют в передаче сигналов внутри клеток, регулируя их размножение. Некоторые мутации способны приводить к постоянной активации RAS, в результате чего клетки начинают размножаться бесконтрольно. Именно поэтому клетки, в которых появляются такие мутации, являются целью для механизма, активирующего управляемую гибель.
Хотя индукция управляемой гибели раковых клеток является многообещающим методом лечения, многие виды опухолей развивают устойчивость к нему
Таким образом, помимо апоптоза и некроптоза, ферроптоз может быть еще одним вариантом преодоления устойчивости раковых клеток к гибели и повышения эффективности противоопухолевой терапии. Хотя сама идея терапии рака на основе ферроптоза является новой и обещает потенциально эффективную стратегию лечения, в настоящее время неизвестно, являются ли раковые клетки, подвергающиеся ферроптозу, иммуногенными, то есть способствуют ли долгосрочному иммунному ответу, предотвращающему рост опухоли и вызывающему ее сокращение.
Клеточная вакцина
В своем исследовании ученые оценили иммуногенность ферроптотических клеток in vitro (в культуре клеток) и in vivo (живой модельный организм) и протестировали их потенциал в качестве альтернативного подхода к иммунотерапии рака. На ранней стадии ферроптоза клетки эффективно уничтожались дендритными клетками костного мозга (BMDC). BMDC относятся к лейкоцитам и играют важную роль в работе иммунной системы. Ферроптоз также способствовал созреванию и активации BMDC. Однако на поздней стадии ферроптоза иммуногенность клеток исчезала.
Важную роль в этом процессе играет взаимодействие химиотерапевтической молекулы с рецепторами на поверхности клетки, которое запускает дальнейшую программу уничтожения. Каждая программа гибели клеток характеризуется определенными сигналами «съешь меня» или «не ешь меня», которые в сочетании с различными рецепторами либо способствуют, либо препятствуют поглощению лейкоцитами.
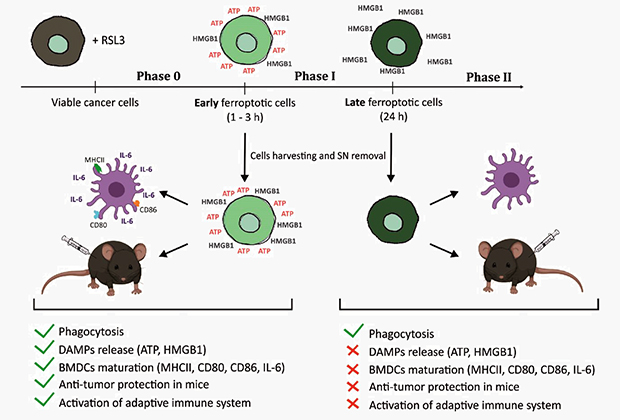
Схема эксперимента с мышами
Ферроптозные клетки на поздней стадии при инъекции в организм мышей не стимулировали иммунную систему и не вызывали антиопухолевого действия. Изображение: BMJ Publishing Group
Данные in vitro были подтверждены in vivo через внедрение (вакцинацию) раковых клеток на ранней стадии ферроптоза в организм иммунокомпетентных мышей и мышей с ослабленным иммунитетом. Защитный эффект от вакцинации ранними ферроптотическими клетками был максимальным, но отсутствовал в поздних ферроптотических клетках, то есть последние не защищали мышей от развития опухоли. Таким образом, исследователи продемонстрировали, что ферроптоз является эффективным индуктором адаптивного иммунного ответа и может способствовать разработке новых стратегий, основанных на вакцинации ферроптотических клеток для иммунотерапии рака.
Рано умирающие клетки, которые характеризуются неповрежденной мембраной, являются более иммуногенными, чем поздно умирающие клетки, которые высвобождают весь свой внутриклеточный материал наружу. Как пишут авторы работы, отсутствие иммуногенности на поздней стадии гибели противоречит здравому смыслу и ставит под сомнение текущую концепцию высокого иммуногенного потенциала клеток на более поздних стадиях гибели. Считалось, что высвобождение всего внутриклеточного содержимого, включая большое количество DAMP (то есть воспалительных стимулов), представляют собой лучший способ вызвать антиген-специфический адаптивный иммунный ответ, опосредованный CD8 + Т-клетками. Однако в настоящее время у исследователей нет объяснения, почему они наблюдали противоположную картину.
Авторы статьи пришли к выводу, что стадия гибели клеток является ключевым фактором иммуногенности ферроптотических раковых клеток и их влияния на противоопухолевый иммунитет. При этом необходимы дальнейшие исследования, чтобы полностью понять молекулярный механизм действия этой разновидности программируемой клеточной смерти.